GRUPOS DE LA TABLA PERIÓDICA

En el presente blog se explicará cada uno de los componentes de los grupos IV, V, VI, y VII; donde se hará una indagación especifica y profunda sobre cada uno de estos grupos.
Explicar de manera clara y concisa cada uno de los los grupos antes mencionados
- Que los espectadores queden interesados en este tema e indaguen mas sobre ello
- Que el presente trabajo sirva como herramienta de repaso

GRUPO IV
El grupo 14 de la tabla periódica es también llamado como la familia del carbono o los carbonoideos.
El grupo 14 está formado por los siguientes elementos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn), plomo (Pb) y flerovio (Fl).

Estos elementos componen más del 28% en masa de la corteza, siendo el silicio el más abundante, luego seguido del carbono. El germanio es el elemento menos abundante.
El silicio es el elemento principal de toda la estructura inorgánica y el carbono es el responsable de la vida orgánica de la superficie terrestre.
Los elementos metálicos de este grupo están clasificados en la tabla periódica como “otros metales” junto a los grupos 13 y 15. Poseen cuatro electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np2 (2 electrones s y 2 electrones p), exhibiendo los siguientes estados de oxidación: +4, +2 y -4: los compuestos con +4 y la mayoría de los de número de oxidación +2 son covalentes. El único ion -4 es el carburo.
Propiedades físicas
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
Por ejemplo, el primer elemento del grupo, el carbono es un no metal duro y sólido a temperatura ambiente. Este elemento puede encontrarse en la naturaleza en forma de carbono amorfo (grafito) y en forma de diamante. Ambas formas alotrópicas poseen coloraciones distintas, siendo el grafito de color negro y el diamante incoloro.

Los elementos silicio y germanio, son los metaloides del grupo, y presentan una dureza intermedia. El silicio posee propiedades intermedias entre el carbono y el germanio. Su forma cristalina es bastante dura y muestra un brillo metálico de color grisáceo.
El metaloide germanio es de color blanco grisáceo lustroso, quebradizo y conserva el brillo a temperaturas normales. Este elemento exhibe la misma estructura cristalina que el diamante.
Los metales de este grupo son el estaño y el plomo. El estaño es de color plateado y maleable. Por su parte, el plomo es un metal pesado que rara vez se encuentra en estado elemental. Es de color plateado con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, inelástico y se funde con facilidad.
Los puntos de fusión y ebullición son menores a medida de que se desciende en el grupo. Esto debido a que se pierde la fuerza de enlace entre los átomos.

Propiedades químicas
Los elementos del grupo 14 poseen algunas propiedades químicas similares, entre estas tenemos:
- No reaccionan con el agua.
- El germanio, estaño y plomo son atacados por los ácidos.
- Son atacados por disoluciones alcalinas desprendiendo hidrógeno, a excepción del elemento carbono.
- Reaccionan con el oxígeno formando óxidos. Siendo los óxidos de carbono y silicio ácidos, el de estaño anfótero (es decir, que reacciona con ácidos y bases calientes) y lo mismo sucede con el plomo.
- Al formar hidruros presentan la habilidad de formar concatenación. La concatenación es la propiedad que poseen algunos elementos de unirse con otro átomo del mismo elemento para formar cadenas ya sea lineales ramificadas o cíclicas. Esta predisposición disminuye al descender en el grupo. La concatenación se le atribuye al elemento carbono, aunque también es un fenómeno suscitado en el silicio. Este fenómeno es la raíz de la química orgánica.

Usos y aplicaciones de los elementos del grupo 14
Carbono.
El carbono presenta dos formas alotrópicas el carbono amorfo que es el grafito y el carbono cristalino que es el diamante. Ambos presentan usos bastantes importantes.
El grafito se mezcla con la arcilla para elaborar las puntas de los lápices. Otra aplicación es como aditivo en lubricantes. También se emplea en la preparación de pinturas anti-radar usadas en el camuflaje de vehículos y aviones militares.

Por su parte, el diamante se utiliza para la elaboración de joyas y como material de corte ya que este presenta una dureza 10 en la escala de Mohs.

El carbono presenta múltiples aplicaciones siendo la más importante como componente de hidrocarburos, principalmente los combustibles fósiles, es decir, petróleo y gas natural. Del petróleo se pueden obtener, después del refino en plantas petroquímicas, los siguientes derivados:
Gases: Empleados para combustible doméstico y de transporte.
Gasolinas: Usados como combustible para motores industriales y automóviles.
Querosén: Combustible de aviación.
Gas-oil: Usado como combustible en motores diesel.
Aceites lubricantes: Empleados en la industria química como engrasado de máquinas o explosivos.
Asfaltos: Para la pavimentación de carreteras.
Parafinas y carbón de coque: Empleados en altos hornos.
Vaselina: Utilizada para pomadas y ungüentos.
Otros subproductos son: alcoholes y bencenos utilizados en la elaboración de fibras textiles, plásticos, lacas, colorantes y disolventes.
Entre otros usos, el carbono también se emplea en aleaciones para obtener acero. El acero es una mezcla de hierro con una cantidad de carbono variable entre el 0,03 % y el 2,14 % en masa de su composición, dependiendo del grado.
En el campo de la medicina se utiliza las pastillas de carbón activado para absorber las toxinas del sistema digestivo en caso de intoxicación, tanto en personas como animales. También se usa como medicina para los problemas digestivos o de flatulencia. Dentro de otras aplicaciones tenemos que se emplea en la extracción de metales, la esterilización de agua potable, en el tratamiento de aguas residuales, purificación de jarabe de azúcar y de glicerina, en mascarillas antigás, en filtros purificadores y en controladores de emisiones de coches, entre otros

El hollín es un pigmento formado principalmente de carbono, que se adquiere mediante la combustión incompleta de diferentes materiales, como aceites, grasas, brea, hulla, maderas resinosas, plantas o gas. Este se agrega a la goma para optimizar sus propiedades mecánicas. Además se utiliza en la producción de electrodos para las baterías.
La fibra de carbono se emplea para mejorar la resistencia mecánica en resinas de poliéster, pero sin aumentar la masa de las mismas.
Silicio.
El silicio es un semimetal y por lo tanto un semiconductor. Este elemento puede controlar el flujo eléctrico mediante el uso de partes de silicio; lo que lo hace indispensable en la industria eléctrica. Se utiliza en los ordenadores, radios, células solares, pantallas LCD y otros aparatos semiconductores.

El silicio también se emplea ampliamente en aleaciones con el aluminio para elaborar piezas fundidas. Dichas se emplean habitualmente en la industria automovilística para producir piezas para autos.
De los compuestos importantes del silicio está el óxido de silicio (IV) o dióxido de silicio (SiO2) o como se le conoce también sílice. Este compuesto se puede encontrar en la arena. La sílice se emplea para elaborar vidrio artificial, cerámicas, ladrillos, cemento, entre otros. El gel de sílice es un desecante, es decir que absorbe la humedad del lugar en que se halla

Las siliconas son materiales que se encuentran dentro del grupo de los polímeros y es un derivado del silicio. Poseen un sin número de aplicaciones como por ejemplo: como selladores en la fabricación de acuarios, en la industria automotriz como lubricante para los frenos, como recubrimiento en telas, en el campo de la medicina para la elaboración de implantes quirúrgicos, en utensilios de cocina, juguetes y como componente activo en los antiespumas.
Germanio.
El germanio al igual que el silicio es un semiconductor ampliamente utilizado en la industria electrónica.

También se emplea en aleaciones con galio y arsénico para elaborar transistores y todo tipo de aparatos tecnológicos.
Los cristales de germanio al mezclarse con elementos como fosforo, arsénico, antimonio, boro, aluminio y galio se comportan como rectificadores y por lo tanto es empleado desde la segunda guerra mundial como detectores para ultra alta frecuencia (UHF) en señales de radar y radio. Estos cristales también son utilizados como transistores y diodos.
El óxido de germanio es empleado en el campo de la medicina como remedio en el tratamiento de algunos tipos de anemia. También se utiliza en la producción de vidrio óptico.

Cápsulas de germanio orgánico
Estaño.
El estaño es usado abundantemente en aleaciones con otros elementos como por ejemplo, con el cobre para obtener bronce, con el plomo en la soldadura, con el titanio para la industria aeroespacial. Por su parte, la aleación estaño-plomo-antimonio se usa para producir el metal de imprenta. Aleado con el niobio es usado en semiconductores y en el galvanizado de hilos conductores.

Recipiente de bronce (Cobre-Estaño)
Este elemento es usado, de igual manera, como capa protectora en el revestimiento de latas de hierro y cobre.
Se emplea para disminuir la fragilidad del vidrio.

El sulfuro de estaño se utiliza para dorar la madera.
Algunos compuestos de estaño también se usan en fungicidas, tintes, pastas dentales y tintes.
Plomo.
El plomo posee una gran cantidad de aplicaciones siendo la más destacada en la elaboración de baterías.

También se emplea en aleaciones, como por ejemplo con estaño para usarse en soldadura, revestimiento y utensilios de radiaciones. Aleado con arsénico para la insonorización de edificaciones, elaboración de perdigones, entre otros.
Algunos de los compuestos de plomo se utilizan en la industria del vidrio como aditivo y pigmento, en la industria electrónica para tubos de televisión, en la industria del plástico como estabilizante, entre otros.

De igual manera, se utilizan como antidetonantes en la gasolina y en pinturas y barnices pero actualmente se han ido reemplazando su uso por la toxicidad del mismo.

Flerovio
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.

GRUPO V
El grupo 15 de la tabla periódica es también llamado como la familia del nitrógeno o los nitrogenoideos.

El grupo 15 está formado por los siguientes elementos: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto (Bi) y el elemento sintético moscovium (Mc). Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
Propiedades físicas
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.

Elementos del grupo 15
Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
El arsénico gris metálico: es la forma más estable de las tres y es un buen conductor del calor pero bastante malo conductor de electricidad.
El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
El arsénico negro: Presenta propiedades intermedias entre las formas anteriores.
De igual manera, el antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
Antimonio puro gris plateado
Antimonio blanco azulado: es su forma más estable y metálica
Antimonio negro: Inestable y no metálico
Antimonio amarillo: Inestable y no metálico
El elemento metálico de este grupo es el bismuto, el cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los pocos metales que se expanden al solidificarse. Su conductividad térmica es menor que la de cualquier otro metal, con excepción del mercurio.
De manera resumida, las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
Propiedades químicas
Los elementos del grupo 15 poseen algunas propiedades químicas similares, entre estas tenemos:
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
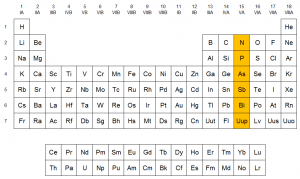
Ubicación de los elementos del grupo 15 en la tabla periódica
Usos y aplicaciones de los elementos del grupo 15
Nitrógeno
El nitrógeno es un gas diatónico que presenta una gran cantidad de aplicaciones industriales.
El gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles. Aunque, en los automóviles comerciales es usual emplear aire normal.

También se pueden inflar neumáticos con nitrógeno gaseoso
El gas nitrógeno se utiliza como un gas aislador, cuando se seca y se presuriza, para equipos de alta tensión.
El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.
Entre otros usos del gas nitrógeno tenemos:
- En la fabricación de piezas eléctricas tales como transistores, diodos y circuitos integrados.
- En la elaboración de acero inoxidable.
- Para disminuir el peligro de incendio en los sistemas militares de combustible de aeronaves.
- Se emplea como una alternativa al dióxido de carbono en la presurización de cerveza.
- En la industria alimentaria se emplea para conservar los alimentos envasados al interrumpir la oxidación de los mismos. Por ejemplo, para inflar los envoltorios que contienen alimentos, como los de frituras, y así mantenerlos frescos más tiempo.
- En medicina el nitrógeno es un elemento importante de casi todas las drogas farmacológicas. El óxido nitroso comúnmente llamado “gas de la risa” se utiliza como un anestésico.
Por su parte, el nitrógeno en su forma líquida, es usado en gastronomía para cocinar al frío los alimentos. Con la técnica del nitrógeno líquido se puede acelerar la cocción para descartar los procesos bacterianos y para reducir que las pérdidas de propiedades organolépticas generen un deterioro. También se utiliza en la preparación de helados.

El nitrógeno líquido se usa en la preparación de cócteles
En el campo de la medicina y la biología, se utiliza también el nitrógeno líquido en una técnica llamada criopreservación. Esta técnica consiste en la congelación a muy bajas temperaturas (entre -80 ºC y -196 ºC) de células o tejidos para reducir las funciones vitales de una célula o un organismo y poder conservarlo en ambientes de vida suspendida por mucho tiempo.

Criopreservación de embriones
De igual manera es usado el nitrógeno líquido para enfriar los detectores de rayos X y las unidades centrales de procesamiento en las computadoras cuando están calientes.
Fósforo
Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
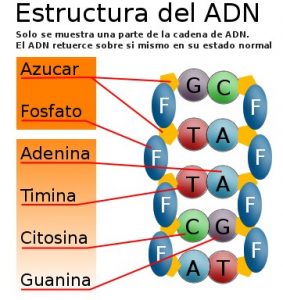
El fósforo en forma de fosfatos esta presente en el ADN
El fósforo rojo se emplea en la fabricación de cerillos, fósforos de seguridad, cohetes y en la elaboración de acero.

En su forma alotrópica blanca, es usado en bombas incendiarias, bombas de humo y en munición trazadora.
Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
El tributilfosfato se emplea el proceso purex para extraer uranio.
El fosfato de calcio es usado para elaborar porcelana fina.
El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.

Detergentes con fosfato
Otros compuestos de fósforo son empleados en la elaboración de pesticidas, fertilizantes, aditivos alimentarios y pasta dentales.
Arsénico
El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.

Otro tipo de aleación es mezclado en pequeñas cantidades con el alfa latón para que sea más duro y resistente a la lixiviación de zinc. El alfa latón se emplea para elaborar piezas de tuberías u otros artículos que están en contacto constante con el agua.
Este metaloide es ampliamente usado en la fabricación de pesticidas, herbicidas e insecticidas, aunque actualmente se ha estado prohibiendo por su alta toxicidad.

Debido a su toxicidad, es usado como conservante de madera y así evitar el contacto con insectos, bacterias y hongos
.

El arsénico se usa como conservante de madera
En medicina fue usado en el tratamiento de algunas enfermedades como la sífilis, mucho antes del descubrimiento de la penicilina.
Actualmente es utilizado como aditivo en pequeñas cantidades en los alimentos de animales para prevenir enfermedades y ayudar a su desarrollo.
También se emplea en el tratamiento de un tipo de cáncer llamado leucemia promielocítica aguda.
Así mismo es empleado en la preparación de soluciones médicas de Fowler para el tratamiento de la psoriasis.
Por su parte, el isótopo arsénico-74 usa como una manera de ubicar tumores en el cuerpo. De hecho se origina imágenes más claras que empleando yodo.
Antimonio
El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.

Láser
También es usado en aleaciones con otros elementos como por ejemplo, con estaño para obtener un metal antifricción; igualmente en el peltre, metal inglés, entre otros. De igual manera, se alea con el plomo para fabricar baterías y acumuladores para así proporcionar resistencia a la corrosión y dureza. Esta misma aleación es utilizada para elaborar piezas de imprenta.

Baterías de automóviles
Los compuestos de antimonio poseen una gran cantidad de aplicaciones industriales, dentro de los cuales se pueden nombrar:
- El trifluoruro de antimonio se utiliza para la fluoración
- El pentacloruro de antimonio se emplea en la cloración
- El tricloruro de antimonio se aprovecha como un catalizador para reacciones de polimerización, craqueo y en la cloración. También es un reactivo utilizado en la prueba de Carr-Price para determinar la vitamina A y otros carotenoides.
- El óxido de antimonio III es usado como retardante de la llama de plásticos, catalizador para fibras plásticas, pigmentos, fritas cerámicas y ciertos minerales.
- El doble tartrato de antimonio y potasio se utiliza en el campo de la medicina
- El sulfuro de antimonio rojo se emplea en equipos de seguridad y en el vulcanizado del caucho.
- El isótopo radiactivo Sb-124 se utiliza como trazador en los oleoductos.
- La mezcla de óxido y sulfuro de antimonio se usa como tinte amarillo para el vidrio y la cerámica.
Bismuto
Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad.
Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Las aleaciones de bismuto han tenido un auge comercial importante ya que se emplea como reemplazo del tóxico plomo.

Anillo de cristales de bismuto
Los compuestos de bismuto poseen una variedad de usos en cosméticos, por ejemplo el oxicloruro de bismuto, usualmente es empleado como pigmento en sombras de ojos, espray para el cabello y esmalte para uñas.

En el campo de la medicina es utilizado en la elaboración de varios medicamentos para el tratamiento de gripes, alergias y diarreas. El subsalicilato de bismuto es empleado para tratar la diarrea, acidez estomacal y malestar estomacal.

Moscovium
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades y conocerse muy poco sobre ellos, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.

GRUPO VI
El grupo 16 de la tabla periódica es también llamado como anfígenos, calcógenos o la familia del oxígeno. El término anfígeno procede del griego y significa formador de ácidos y bases. Por su parte, el término calcógeno proviene del griego y significa formador de minerales.

El grupo 16 está formado por los siguientes elementos: Oxígeno (O), Azufre (S), Selenio (Se), Telurio (Te), Polonio (Po) y el elemento sintético Livermorio (Lv).
El oxígeno se halla en la naturaleza siendo el elemento más abundante de la tierra con un 50,5% en masa de la corteza, encontrándose en el aire y combinado con hidrógeno para producir agua. También se encuentra formando óxidos, hidróxidos y algunas sales. Por su parte, el azufre también se muestra en cantidad en estado elemental y combinado formando compuestos. El selenio y el telurio se hallan libres y combinados, no obstante con menos abundancia que los elementos anteriores. En último lugar, tenemos al polonio, el cual es un elemento radiactivo que se halla difícilmente en la naturaleza, generalmente en forma de sales.
En cuanto a su configuración electrónica, poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np4 (2 electrones s y 4 electrones p), exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos últimos se debe a la existencia de orbitales d a partir del azufre.
Propiedades físicas
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta del selenio al polonio.
El oxígeno en ambientes estándar de presión y temperatura se encuentra formando el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Otro alótropo importante es el trioxígeno (O3) o como normalmente se le conoce, el ozono. El ozono es un gas de olor picante y habitualmente incoloro, pero en altas concentraciones puede tornarse levemente azulado.
El azufre es un no metal sólido de color amarillo limón que presenta un olor característico. Se presenta en varias formas alotrópicas, por ejemplo en estado sólido se pueden apreciar las variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn). Por su parte, en estado líquido formando anillos S8 y cadenas de longitud variable y en fase gaseosa formando cicloazufre, que son cadenas Sn (n = 3-10), S2.

Elementos del grupo 16 en estado elemental
El selenio es un metaloide que presenta, al igual que el azufre, varias formas alotrópicas. Primero el selenio rojo coloidal, el cual está compuesto por moléculas Se8. El selenio negro vítreoformado por anillos Sen con n muy grande y variable (forma amorfa) y por último el selenio gris cristalino de estructura hexagonal, la cual es la forma más común y análoga a la del azufre plástico. Este alótropo exhibe aspecto metálico, de hecho es un semimetal y es fotoconductor.
El telurio es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico.
Y finalmente el polonio, el cual es un metaloide altamente radiactivo, con una química equivalente al telurio y al bismuto. Este elemento muestra dos alótropos: el cúbico simple y el romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
Propiedades químicas
Los elementos del grupo 16 ostentan algunas propiedades químicas similares, entre estas tenemos:
- No reaccionan con el agua.
- No reaccionan con las bases a excepción del azufre.
- Reaccionan con el ácido nítrico concentrado, excepto el oxígeno.
- Forman óxidos, sulfuros, seleniuros y telururos con los metales, y dicha estabilidad se ve reducida desde el oxígeno al teluro.
- Con el oxígeno componen dióxidos que con agua originan oxoácidos. El carácter ácido de los oxoácidos disminuye a medida que se desciende en el grupo.
- Los calcogenuros de hidrógeno son todos débiles en disolución acuosa y su carácter ácido aumenta a medida que se desciende en el grupo.
- Las combinaciones hidrogenadas de estos elementos (excepto el agua) son gases tóxicos de olor desagradable.
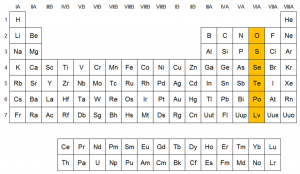
Ubicación del grupo 16 en la tabla periódica
Usos y aplicaciones de los elementos del grupo 16
Oxígeno.
El oxígeno es uno de los elementos más importantes y por tal razón posee una gran cantidad de aplicaciones. Principalmente, es utilizado en medicina como terapia para las personas que tienen dificultad para respirar debido a alguna enfermedad como enfisema o neumonía. El oxígeno gaseoso es venenoso para las bacterias anaeróbicas que producen gangrena (muerte de tejidos orgánicos), por lo que se emplea para eliminarlos. El envenenamiento por monóxido de carbono se trata también con oxígeno gaseoso.
El alótropo ozono es empleado en una terapia denominada ozonoterapia para aliviar enfermedades como artritis, óseas, hepáticas y neurológicas entre otras. El ozono una vez introducido al organismo desencadena una serie de reacciones metabólicas positivas que ayudan a combatir a todos estos trastornos.

El oxígeno con un alto grado de pureza se emplea en los trajes espaciales para que los astronautas puedan respirar.

De igual manera, es usado en los tanques de buceo, no obstante, se suele combinar con aire normal. Los tanques de oxígeno son también utilizados frecuentemente en aviones y submarinos en caso de emergencias.

Igualmente, el oxígeno puro es usado para garantizar la combustión completa de los productos químicos.
Una gran cantidad del oxígeno producido para aplicaciones comerciales se emplea para convertir el mineral de hierro en acero.
Entre otros usos del oxígeno tenemos:
Para el tratamiento de agua
Cortar y soldar metales
Obtención de polímeros de poliéster y los anticongelantes. Los polímeros se usan para fabricar plástico y telas.
El oxígeno líquido es usado como comburente para el lanzamiento de cohetes espaciales, generalmente empleando RP-1 como combustible, en una mezcla llamada Kerolox.
Azufre.
Es un elemento químico fundamental y un componente principal de los aminoácidos cisteina y metionina y, por lo tanto, indispensable para la síntesis de proteínas presentes en todos los organismos vivos. Por tal razón, muchos agricultores que cultivan alimentos orgánicos emplean azufre como un pesticida y fungicida natural.

Pero la aplicación más destacada en el ámbito comercial de este elemento es en la obtención de ácido sulfúrico. El ácido sulfúrico es sumamente necesario para una gran cantidad de industrias. Este compuesto se emplea en la elaboración de fertilizantes, tratamiento de aguas residuales, baterías de plomo para vehículos, extracción de mineral, eliminación de óxido de hierro, producción de nylon y obtención de ácido clorhídrico.

H2SO4, ácido sulfúrico
El azufre se usa para vulcanizar caucho. La vulcanización es un proceso mediante el cual se calienta el caucho crudo en presencia de azufre, con la finalidad de tornarlo más duro y resistente al frío. El caucho vulcanizado se emplea para elaborar neumáticos para automóviles, mangueras, suelas de zapatos y discos de hockey sobre hielo.

Entre los compuestos de azufre más utilizados tenemos:
El sulfato de magnesio se emplea como laxante, en sales de baño y como un complemento de magnesio para las plantas.
El disulfuro de carbono se usa para elaborar celofán y rayón.
Los sulfitos se emplean para blanquear el papel y conservar la fruta.
Selenio.
Anteriormente estudiamos las formas alotrópicas del selenio. Estas diferentes formas le permiten al selenio tener múltiples aplicaciones dependiendo del alótropo. Por ejemplo, el selenio gris conduce la electricidad, sin embargo su conductividad varía con la intensidad luminosa, es decir, es buen conductor en la luz que en la oscuridad. Por tal razón, se emplea en dispositivos fotoeléctricos, como las células solares, cámaras de rayos x, fotocopiadoras, medidores de luz, diodos LED de color azul y blanco, entre otros.

LED de color azul
Por su parte, el selenio rojo o como seleniuro de sodio se emplea para proporcionar un color rojo carmesí al vidrio, barnices y esmaltes. También se puede usar para eliminar las tintas de color verde o amarillo ocasionados por otras impurezas durante el proceso de elaboración de vidrio.

La aleación selenio con el bismuto se utiliza para elaborar un latón sin plomo.
El compuesto sulfuro de selenio es un componente habitual en el champú anticaspa que elimina el hongo que origina la descamación del cuero cabelludo. Asimismo se puede destinar para tratar algunos problemas de la piel producidos por otros hongos.

Telurio.
El telurio aleado con otros elementos es utilizado en la fabricación de discos compactos regrabables. La capa del CD-RW que contiene la información está constituida por una aleación cristalina de plata, indio, antimonio y telurio.

También se alea con cobre y plomo para mejorar la tenacidad y dureza a la hora de elaborar rectificadores y dispositivos termoeléctricos.
Al igual que el selenio, es utilizado para teñir el vidrio, en este caso de color azul.

El teluro coloidal se aprovecha para la preparación de insecticidas, germicidas y fungicidas.
Es usado como agente vulcanizador en el proceso de elaboración de caucho sintético y natural.
Polonio.
Los isótopos del polonio son una excelente fuente de radiación alfa pura. Aleado con berilio, es una fuente de neutrones.

También se usa en dispositivos destinados a la ionización el aire para la eliminación de cargas electrostáticas en cepillos específicos para limpiar el polvo almacenado en películas fotográficas e impresiones.

Por su parte, el isótopo Po-210 se emplea como fuente ligera de calor para proveer energía a las células termoeléctricas de ciertos satélites artificiales y sondas lunares.
El Po-210 está presente en el humo de tabaco. Desde los años 60, las empresas de producción de tabaco se comprometieron a eliminar esta sustancia de sus productos pero no lo han logrado.

Livermorio.
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en la investigación científica.

GRUPO VII
El grupo 17 de la tabla periódica es también conocido como halógenos. El término halógeno procede del griego y significa formador de sales. Dicho término, surge por la propiedad que posee cada uno de los halógenos de formar, con el sodio, una sal similar a la sal común (cloruro de sodio).

Flúor: Elemento cabecilla de grupo
El grupo 17 está formado por los siguientes elementos: flúor (F), cloro (Cl), bromo (Br), yodo (I), ástato (At) y tennessine (Ts).
Estos elementos se hallan en estado elemental formando moléculas diatómicas, aunque aún no está comprobado con el ástato), las cuales son químicamente activas y de fórmula X2. Posee la siguiente distribución electrónica: s2p5. Para llenar por completo su último nivel energético se necesita de un electrón más, por lo que poseen disposición a formar un ion mononegativo llamado haluro (X–).
Propiedades físicas.
Son elementos no metálicos.
El carácter metálico aumenta según se desciende en el grupo, es decir, a medida que aumenta el número atómico, por lo tanto, el yodo posee brillo metálico.
Los halógenos se presentan en moléculas diatómicas y sus átomos se mantienen unidos por enlace covalente simple y la fuerza de dicho enlace disminuye al descender en el grupo.
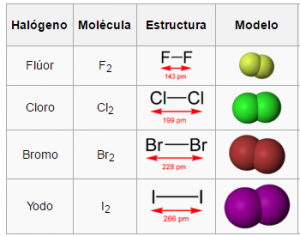
Los puntos de fusión y ebullición aumentan al descender en el grupo.
Estos elementos, a temperatura ambiente, se hallan en los tres estados de la materia: en estado sólido el iodo y ástato, en estado líquido: bromo y en estado gaseoso el flúor y cloro.
El flúor es un gas de color amarillo claro, levemente más pesado que el aire, corrosivo y de olor fuerte e irritante.
El cloro es un gas amarillo verdoso de olor irritante y fuerte.
El bromo es un líquido de color rojo oscuro, muchísimo más denso que el agua, que fácilmente se evapora originando un vapor rojizo venenoso.
El yodo es un sólido cristalino de color negro y brillante, que sublima originando un vapor violeta bastante denso, venenoso y con un olor fuerte e irritante semejante al cloro.
El ástato es muy raro, debido a que es producto intermedio de unas series de desintegración radiactiva.

Propiedades químicas
Los halógenos poseen 7 electrones en su capa más externa, lo que les proporciona un número de oxidación de -1, siendo considerablemente reactivos. Dicha reactividad disminuye según aumenta el número atómico.
De igual manera, también exhiben los estados de oxidación +1, +3, +5, +7, con excepción del flúor, el cual es el elemento más reactivo y más electronegativo del grupo y de la tabla periódica.

Ubicación de los halógenos en la tabla periódica
Se disuelven en agua y reaccionan parcialmente con ella, a excepción del flúor que la oxida.
Reaccionan con el oxígeno produciendo óxidos inestables. Dicha reactividad disminuye a medida que se desciende en el grupo.
Reaccionan con el hidrógeno para originar haluros de hidrógeno, los cuales se disuelven en agua, generando los ácidos hidrácidos. El ácido más fuerte es el yoduro de hidrógeno (HI).

Reaccionan con algunos metales formando haluros metálicos, casi todos ellos iónicos.
Reacción química entre el yodo y el aluminio para generar yoduro de aluminio.
Usos y aplicaciones de los elementos del grupo 17
Flúor
El elemento cabecera de grupo posee una gran cantidad de aplicaciones en la industria y cotidianidad. Por ejemplo, es usado para elaborar televisores de pantallas plasma, pantallas planas y sistemas microelectromecánicos.
En medicina es utilizado el flúor en ciertos antibióticos que intervienen en contra de una extensa gama de bacterias. Estos compuestos de flúor también son empleados en la preparación de anestésicos.
El flúor-18 es el radionúclido del flúor con el mayor período de semidesintegración: 109,771 minutos. Por lo cual es utilizado comercialmente como fuente de positrones. De hecho su aplicación primordial es en la obtención de fluorodesoxiglucosa radiofarmacéutica para su uso en la técnica clínica de tomografía por emisión de positrones.
Ciertos compuestos de flúor como fluoruro de sodio, fluoruro estañoso y monofluorofosfato de sodio, son agregados a las cremas dentales para prevenir las caries.

El fluoruro de sodio también es empleado como complemento de soldaduras, metalurgia, en la preparación de raticidas, en la industria del vidrio, en la fluoración del agua, entre otros.
El flúor es utilizado para obtener ácido fluorhídrico, el cual es empleado para grabar vidrio, habitualmente en las bombillas.
De igual manera, el flúor se usa para la elaboración de halones. Los halones son hidrocarburos halogenados utilizados como agentes extinguidores de incendios, como por ejemplo, el freón.
A partir del hexafluoruro de uranio se puede obtener uranio puro. Debido a que sus moléculas presentan una gran masa, es posible usar el centrifugado para separar los isótopos U-235 y U-238, adquiriéndose uranio puro.
El flúor es extensamente empleado en la producción de hexafluoruro de azufre, el cual es usado como dieléctrico, es decir, como aislante en la electrónica. Otro compuesto de flúor que es utilizado como aislante eléctrico es el politetrafluoruroetileno, un polímero mejor conocido como teflón. Este materia es utilizado comúnmente en utensilios de cocina, como sartenes y ollas, debido a su capacidad de rozamiento baja y facilidad de limpieza.

Sarten de teflón
Cloro
El uso más comercial del cloro es en su forma de hipoclorito de sodio, cuya disolución en agua es llamada lejía.

Este compuesto es utilizado abundantemente para eliminar las bacterias en las piscinas y en el agua potable. Asimismo se emplea en los desinfectantes y blanqueadores. De hecho el cloro es muy efectivo contra la bacteria Escherichia coli.

El cloruro de polivinilo o PVC y otros plásticos son obtenidos a partir del cloro. El PVC se emplea para elaborar ropa, pisos, tejas del techo, cables eléctricos, tubos flexibles, tuberías, estatuas, camas de agua y estructuras inflables.

Otro uso de este elemento es en la obtención de bromo a partir de las salmueras, mediante la oxidación del bromuro con cloro:
2Br – + Cl2 → Br2 + 2Cl-
Es necesario utilizar un proceso de destilación para separarlo del Cl2.
Otro compuesto de cloro que posee importancia comercial es el cloruro de metilo, el cual es empleado en medicina como anestésico. De igual manera, se usa para fabricar algunos polímeros de silicona y para extraer grasas, aceites y resinas.
El cloroformo, triclorometano o tricloruro de metilo, es un compuesto químico de fórmula química CHCl3 que puede obtenerse por cloración como derivado del metano o del alcohol etílico. Este compuesto se emplea como disolvente habitual en los laboratorios de química y biología, por ejemplo en la extracción de vitaminas y sabores. Entre otras aplicaciones del cloroformo es en la extracción y purificación de la penicilina y otros antibióticos. Además para la purificación de diversos alcaloides.

El tricloroetileno es otro compuesto de cloro de suma importancia, que se usa primordialmente como solvente para eliminar grasa de partes metálicas, sin embargo también es un componente en adhesivos, líquidos decapantes de pintura, para corregir escritura a máquina y quitamanchas.
En el pasado se empleaba con más frecuencia el gas cloro en las fuerzas armadas debido a que es un gas venenoso. En la actualidad es más utilizado por grupos terroristas.
Bromo.
El bromo y sus compuestos son empleados en la medicina, específicamente el bromuro de potasio, el cual fue empleado en el siglo 19 como anticonvulsivo. En la actualidad es solo utilizado en animales, debido a que causa disfunciones neurológicas en los seres humanos.
El bromo se emplea ampliamente en la elaboración de retardantes de llama. Funciona de la siguiente manera: cuando esta sustancia se quema, el bromo bloquea el fuego del oxígeno produciendo que este se extinga.
El bromuro que se obtiene del calcio, sodio y zinc se emplea para preparar soluciones específicas para la perforación de sal. También en la elaboración de aceites vegetales bromados que se emplean como emulsión en ciertas marcas de bebidas gaseosas.

En menor medida, el bromo se usa en el mantenimiento de piscinas, específicamente en baños termales. Asimismo, en la desinfección de aguas industriales, como antiséptico e insecticida.

El bromo para piscinas está alterado de forma tal que no afecte la salud del bañista
En la industria textil es empleado en la fabricación de colorantes para telas.

Un compuesto importante del bromo es el bromuro de etilo, el cual es una sustancia tóxica usada como antidetonante en la gasolina, que al igual que el plomo previene la degradación del motor. La mezcla de plomo (tetraetilplomo) y bromo es sumamente tóxica, ya que genera un compuesto volátil llamado bromuro de plomo, el cual se escapa con los gases quemados hacia el ambiente, contaminándolo. Esta aplicación perdió interés económico desde la década de los años 70, debido a los problemas ambientales que generó.
Sin embargo, se ha retomado el uso del bromo en automóviles, pero en este caso en baterías para vehículos eléctricos para ayudar que estos no provoquen ningún tipo de emisiones.
Yodo.
El uso principal que presenta el yodo es en el campo de la medicina. Por ejemplo, las soluciones de yodo- alcohol y complejos de yodo se emplean como antisépticos y desinfectantes. De hecho una gran cantidad de productos de esterilización usados en el cuerpo contienen yodo, ya que es un eficaz limpiador para las heridas. Además es utilizado en forma de tabletas o en estado líquido para purificar el agua.

Por su parte, los isótopos radiactivos del yodo se aprovechan en la medicina nuclear y en otros campos como trazadores.
También es utilizado en la prevención del bocio, que es la inflamación del área de la garganta y la glándula de la tiroides. La insuficiencia de yodo es la causa más frecuente del bocio. El cuerpo requiere de yodo para producir la hormona tiroidea.

Además, el yodo también presenta aplicaciones del tipo no médicas como por ejemplo, en la elaboración de emulsiones fotográficas, preparación de tintes y lámparas halógenas.

Otro uso significativo es para originar la lluvia con la finalidad de obtener mejoras en el campo de la agricultura. Esto se logra utilizando el yoduro de plata dispersado en las nubes.
Ástato.
El ástato tiene 31 isótopos elevadamente inestables, por lo que solo se han podido producir unos pocos microgramos en los laboratorios. Por esta razón, no presenta alguna aplicabilidad comercial, salvo en investigaciones científicas y médicas.

Tennessine.
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.

VÍDEOS

http://www.quimicaencasa.com/grupo-14-la-tabla-periodica-familia-del-carbono/
https://www.quimicas.net/2015/08/los-carbonoideos.html
http://www.quimicaencasa.com/grupo-15-la-tabla-periodica-familia-del-nitrogeno/
https://www.quimicas.net/2015/08/los-nitrogenoides.html
http://www.quimicaencasa.com/grupo-16-la-tabla-periodica-familia-del-oxigeno/
https://earr.webnode.es/products/grupo-16/
http://www.quimicaencasa.com/grupo-17-la-tabla-periodica-halogenos/
https://earr.webnode.es/products/grupo-17-o-halogenos/




Comentarios
Publicar un comentario