REACCIÓN QUÍMICA Y ECUACIÓN QUÍMICA
INTRODUCCIÓN
 En este blog se explicara específicamente y detalladamente la definición, las partes, las leyes, la clasificación, entre otras cosas sobre las reacciones químicas y las ecuaciones química. También se intentara ser lo mas clara posible para que se entienda completamente estos temas.
En este blog se explicara específicamente y detalladamente la definición, las partes, las leyes, la clasificación, entre otras cosas sobre las reacciones químicas y las ecuaciones química. También se intentara ser lo mas clara posible para que se entienda completamente estos temas.
OBJETIVOS
- Definir de manera completa y detallada que es una reacción y una ecuación química
- Dejar totalmente claro las partes que constituyen una reacción química y una ecuación química
- Mostrar la importancia de las reacciones y las ecuaciones en la química
REACCIÓN QUÍMICA
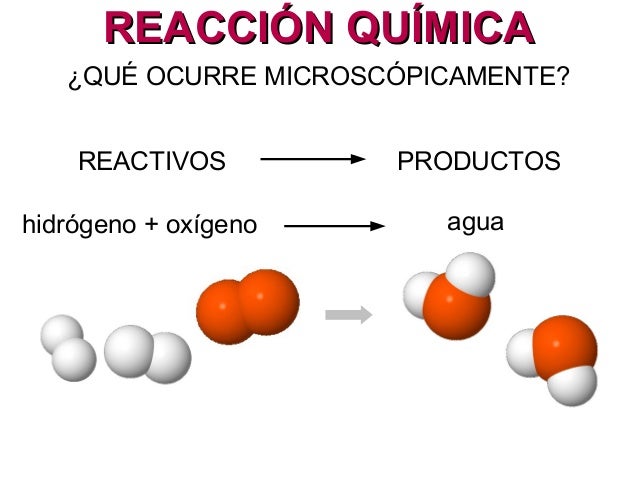
 La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
Estas reacciones químicas suceden cuando se rompen o se forman enlaces químicos entre los átomos y se produce cuando las sustancias participantes en ella se transforman en otras distintas. Las sustancias que participan en una reacción química se conocen como los reactivos, y las sustancias que se producen al final de la reacción se conocen como los productos. Se dibuja una flecha entre los reactivos y los productos para indicar la dirección de la reacción química, aunque una reacción química no siempre es una "vía de un solo sentido"
Ejemplos:
2, H, start subscript, 2, end subscript right arrow 2, H, start subscript, 2, end subscript, O, left parenthesis, a, g, u, a, right parenthesis +
PARTES DE UNA REACCIÓN QUÍMICA
Reactante o Reactivo
Los reactivos o reactantes son aquellas sustancias que desarrollan una interacción con otras en una reacción química produciendo otras sustancias con características, propiedades y conformación diferente a las que se les llama productos o productos de reacción. Los reactivos son compuestos químicos que se clasifican tomando en cuenta distintas variables, tales como la reactividad en reacciones químicas, las propiedades fisicoquímicas y las características del uso del reactivo.
Los reactivos o reactantes pueden clasificarse en las siguientes denominaciones:
- PA: Estos se utilizan en aplicaciones analíticas.
- PB: Se destinan al área de la bioquímica.
- DC: Su objeto de estudio son las aplicaciones del análisis clínico.
- QP: Sus siglas significan químicamente puro y se utiliza generalmente en laboratorio.
Productos Reactivos y productos.
Los productos de una reacción química se definen como los químicos que resultan de la separación y re acomodación de los reactivos. Estos aparecen al lado derecho de la ecuación en la reacción química. De forma general, los productos son moléculas mucho más estables que los reactivos.
Las leyes de las reacciones químicas
 En las reacciones químicas se cumplen las leyes ponderales, de esta la más importante es la ley de conservación de la masa o ley de Lavoisier, formulada por este químico en 1774, que postula que en toda reacción química la masa de los reactivos es igual a la masa de los productos.
En las reacciones químicas se cumplen las leyes ponderales, de esta la más importante es la ley de conservación de la masa o ley de Lavoisier, formulada por este químico en 1774, que postula que en toda reacción química la masa de los reactivos es igual a la masa de los productos.Fue Dalton quien completó la explicación a esta ley algunos años después, al indicar que en una reacción química el número de átomos no varía al comparar los reactivos con los productos, solo cambia su organización, por lo que la masa de se conserva.
Otro parámetro importante en las reacciones químicas es su velocidad de reacción, ya que no todas tardan el mismo tiempo en producirse. La velocidad de reacción se define como la cantidad de producto que aparece por unidad de tiempo o la cantidad de reactivo que desaparece por unidad de tiempo.
Aunque cada reacción tiene diferente velocidad, ciertos factores pueden hacer que esta tienda a aumentar o a disminuir: la superficie de contacto y la temperatura son algunos de ellos.
CLASIFICACIÓN DE LAS REACCIONES
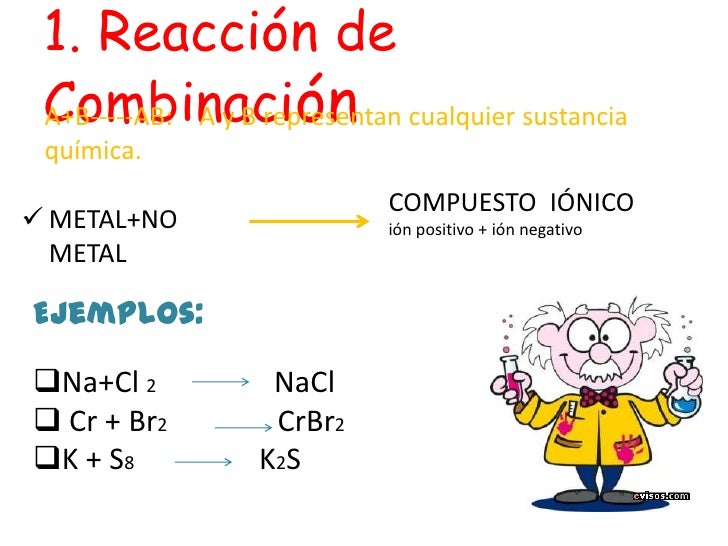
Reacciones de combinación
Son reacciones en las que dos o más sustancias reaccionan para formar un único compuesto. Por ejemplo el hidrógeno y el oxígeno reaccionan para dar agua.
2 H2(g) + O2 (g) -> 2 H2O (l)
Reacciones de descomposición
Son reacciones en las que una sustancia se transforma en dos o más sustancias sencillas, para que esto sucede debemos suministrar energía. Si al carbonato de calcio le comunicamos calor, este se descompone en óxido de calcio y dióxido de carbono.
CaCO3 -> CaO + CO2

Otro ejemplo de reacción de descomposición es la electrólisis, donde por acción de la energía eléctrica el agua se descompone en hidrógeno y oxígeno.
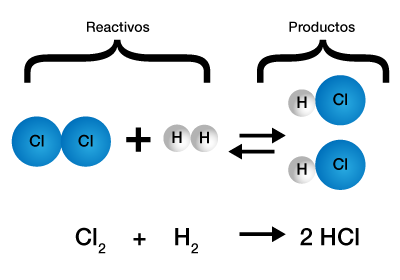
Reacciones de sustitución
También se llaman de desplazamiento, son reacciones en las que un elemento de un compuesto es desplazado por otro elemento de otro reactivo. Un ejemplo de este tipo de reacciones es la sustitución del hidrógeno de un ácido por un metal:
Ni (s) + 2 HCl (aq) -> NiCl2 (aq) + H2 (g)
En otras ocasiones se produce un intercambio de elementos entre los reactivos que reaccionan:
3 HCl (aq) + Al(OH)3 (s) -> AlCl3 (aq) + 3 H2 O (l)

Reacciones de oxidación y reducción
Una reacción de oxidación es aquella en la que un elemento o compuesto gana oxígeno:
2 Fe (s) + O2 (g) -> 2 FeO (s)
|
Sin embargo, una reacción de reducción es aquella en la que un compuesto pierde oxígeno. Las dos reacciones se producen al mismo tiempo. En metalurgia son muy importante estas reacciones ya que nos permiten obtener los metales libres que normalmente nos los encontramos en la naturaleza formando óxidos.
FeO (s) + C (s) -> Fe (s) + CO (g)
Reacción Ácido-Base
también llamada reacción de neutralización, es aquella que ocurre entre un ácido y una base para dar lugar a una sal y agua:
HCl + NaOH → NaCl + H2O
H2SO4 + 2 NaOH → Na2SO4 + H2O

ECUACIÓN QUÍMICA
Es una forma esquemática y sencilla de expresar, mediante símbolos y fórmulas, los cambios ocurridos en el transcurso de una reacción.
Partes de una ecuación química
Sustancias reaccionantes o reactivos
Son las sustancias que reaccionan. Están colocadas antes de la flecha o el signo igual a.
Sustancias productos
Son las sustancias que se forman. Están colocadas después de la flecha o el signo igual a (=). Los científicos suelen representar las reacciones químicas mediante símbolos y fórmulas de las sustancias que intervienen y se producen.
- El símbolo "+" : entre las sustancias reaccionantes se lee como "reacciona con", entre las sustancias productos se lee como "y".
- La flecha o el signo igual a: separa a las sustancias reaccionantes de las sustancias productos. Se lee "produce".
- Un triángulo sobre la flecha o el signo igual a: significa "calor". Los reactivos deben calentarse para que la reacción se efectúe.
- Algunas veces, la ecuación muestra el estado de agregación de las sustancias que participan, indicando una letra minúscula entre paréntesis, después de cada sustancia:(s): sólido (l): líquido (g):gas, para la sustancia en disolución se usa el símbolo (ac) que significa acuoso.
- Coeficientes: Son los números colocados antes de cada sustancia. Indican el número de moles que reaccionan de cada reactivo y el número de moles que se forman de cada producto. Esto se hace siempre debido a la Ley de Conservación de la masa.

Ajuste o balanceo
 Ajustar o balancear una ecuación química es igualar el número y clase de partículas (átomos, moléculas o inoes) reaccionantes con los productos, con la finalidad de cumplir la Ley de Conservación de la masa.
Ajustar o balancear una ecuación química es igualar el número y clase de partículas (átomos, moléculas o inoes) reaccionantes con los productos, con la finalidad de cumplir la Ley de Conservación de la masa.
Para ajustar o balancear una ecuación química, se debe considerar lo siguiente:
- Conocer las sustancias reaccionantes y productos.
- Revisar que la ecuación esté completa y escrita correctamente.
- Verificar si la ecuación se encuentra ya ajustada.
- Los subíndices indican la cantidad del átomo indicado en la molécula.
- Los coeficientes afectan a toda la sustancia que preceden.
- Se comienza ajustar por el elemento metálico, luego el no metal(excepto Oxígeno e Hidrógeno.
- El Hidrógeno y el Oxígeno se equilibran al final y en ese orden, porque generalmente forman agua (sustancia de relleno). Esto no altera la ecuación, porque toda reacción se realiza en solución acuosa o produce sustancias que contienen agua de cristalización.
- Usar números enteros y los menores posibles para balancear.
- Escribir el número como coeficiente de la fórmula pertinente; cuando el coeficiente es (1) no se escribe, se sobreentiende.
- No se deben cambiar los subíndices de las fórmulas, ni dividir la fórmula para colocar el coeficiente en medio de ella.
- Contar el número de átomos multiplicando el coeficiente por los respectivos subíndices de las fórmulas y sumando todos los átomos de un elemento que estén de un mismo lado de la ecuación.
- Verificar el balanceo final y reajustar, si es necesario.
Métodos para ajustar (Balancear) Ecuaciones
Existen diferentes métodos que se utilizan según convengan, de acuerdo al tipo de reacción, las cuales pueden ocurrir:
- Sin cambio de estados de oxidación en ningún elemento reaccionante:
- Ensayo y Error o Tanteo.
- Mínimo Común Múltiplo.
- Coeficientes Indeterminados o Algebraico.
- Algunos elementos cambian su valencia:
- Redox.
- Ion Electrón o Semirreacción: En medio ácido y básico.

Ajuste por Tanteo
Como su nombre lo indica, es una manera de ajustar una ecuación química buscando por tanteo. Se emplea para balancear ecuaciones sencillas. Se realiza al "cálculo" tratando de igualar ambos miembros. Para ello utilizaremos el siguiente ejemplo:
Ajustar la ecuación: Al(OH)3(ac) + H2SO4(ac) = Al2(SO4)3(ac)+ H2O
- Ajustamos el metal aluminio
- Seguimos con el no metal azufre
- Continuamos con el hidrógeno y el oxígeno
Ecuación ajustada: 2Al(OH)3(ac) + 3H2SO4(ac) = Al2(SO4)3(ac) + 6H2O
Interpretación de una ecuación química
Existen dos puntos de vista o criterios a la hora de interpretar una ecuación química. Estas interpretaciones reciben el nombre de Cualitativa y Cuantitativa.
Cualitativa
Desde el punto de vista cualitativo, expresan la naturaleza de las sustancias que reaccionan y se producen.
Cuantitativa
Desde el punto de vista cuantitativo, expresan la relación entre el número de partículas (átomos, moléculas, iones) que intervienen en una reacción química.
CONCLUSIONES
- Las reacciones químicas son una base fundamental en la química
- Las reacciones químicas se diferencian de las ecuaciones porque estas ultimas son los símbolos que se utilizan para representar una reacción química
- Las reacciones químicas pueden producir cosas sorprendentes e interesantes como las que se muestran en las imágenes (gifs)
- La matemática y la química están estrechamente relacionadas
WEBGRAFIA







BUEN TRABAJO
ResponderBorrar