NEUTRALIZACION, INDICADORES, TITULACIÓN, PH
- Explicar de manera sencilla todos los conceptos pertenecientes a química, para que todas las personas puedan comprender
- Crear en las personas un conocimiento duradero y claro de cada cosa
- Que cada estudiante y persona pueda utilizar sin ninguna barrera, todo lo aprendido en este blog
- Que las personas logren tener el aprendizaje y tengas mas ganas de buscar sobre esto
En el momento de la neutralización se cumple que el número de equivalentes de ácido que han reaccionado (N • V) es igual al número de equivalentes de la base (N' • V'):
N • V = N' • V'
|
· Cuando reacciona un ácido con una base se produce una sal y agua. Esta reacción se denomina neutralización porque el ácido y la base dejan de serlo cuando reaccionan entre sí, pero no significa, necesariamente, que el pH de la disolución resultante sea neutro.
Ácido + Base ð Sal + Agua
En una volumetría se miden volúmenes haciendo uso de material muy simple: bureta y pipeta. Al ser esta volumetría de neutralización o ácido-base lo que se hace es provocar una reacción ácido-base debiendo determinar el punto de equivalencia, es decir: en que momento el número de equivalentes de ácido añadidos coinciden con el número de equivalentes de base. La determinación de este punto de equivalencia se realiza con un indicador ácido-base apropiado. El indicador elegido debe virar en un intervalo de pH en el que quede incluido el pH de la disolución obtenida cuando se alcanza el punto de equivalencia. El alumno puede calcular, de forma aproximada, el pH de la disolución de acetato de sodio obtenida y decidir qué indicador entre los disponibles en el laboratorio es el adecuado para tal determinación.


La acidez y la basicidad constituyen el conjunto de propiedades características de dos importantes grupos de sustancias químicas: los ácidos y las bases. Las ideas actuales sobre tales conceptos químicos consideran los ácidos como dadores de protones y las bases como aceptoras. Los procesos en los que interviene un ácido interviene también su base conjugada, que es la sustancia que recibe el protón cedido por el ácido. Tales procesos se denominan reacciones ácido-base.
La acidez y la basicidad son dos formas contrapuestas de comportamiento de las sustancias químicas cuyo estudio atrajo siempre la atención de los químicos. En los albores mismos de la ciencia química, Boyle y Lavoisier estudiaron sistemáticamente el comportamiento de las sustancias agrupadas bajo los términos de ácido y álcali (base).
Pero junto con los estudios descriptivos de sus propiedades, el avance de los conocimientos sobre la estructura del átomo y sobre la naturaleza íntima de los procesos químicos aportó nuevas ideas sobre los conceptos de ácido y de base.
En la actualidad, el resultado final de la evolución de esos dos conceptos científicos constituye un importante capítulo de la química general que resulta imprescindible para entender la multitud de procesos químicos que, ya sea en la materia viva, ya sea en la materia inerte, se engloban bajo el nombre de reacciones ácido-base
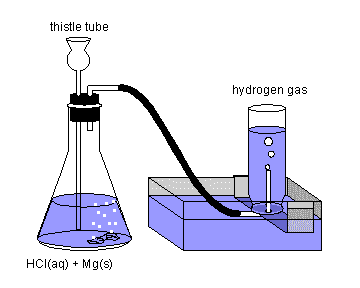

Por medio de las volumetrías de neutralización determinamos concentraciones de ácidos o de bases midiendo volúmenes equivalentes de bases o de ácidos de concentración conocida.
· Según las cantidades de sustancia (número de moles) relativas de estas sustancias y la estequiometría de la reacción se pueden dar tres situaciones:
a) exceso de ácido: reacciona toda la base con parte del ácido presente y queda un exceso de ácido sin reaccionar: la disolución final será ácida (pH < 7)
b) exceso de base: reacciona todo el ácido con parte de la base presente y queda un exceso de base sin reaccionar: la disolución final será básica (pH > 7)
c) proporción estequiométrica de ácido y base: todo el ácido y toda la base presente reaccionan entre sí, no queda exceso de ninguno de ellos. La neutralización es completa. Se ha alcanzado el punto de equivalencia. El pH de la disolución final dependerá de la sal que se forme, ya que ésta podrá sufrir hidrólisis y por ello el pH en el punto de equivalencia puede ser distinto de siete. Será siete (neutra) si la sal formada proviene de ácido fuerte-base fuerte, como el NaCl.
Tengamos en cuenta que:
pH= - log [H+] ð [H+] = 10-pH ; [H+] · [OH-]=10-14
Valoraciones ácido - base
· Por medio de una valoración ácido-base se determina la concentración de un ácido en disolución a partir de la concentración conocida de una base, o viceversa, basándose en la reacción de neutralización.
· La valoración se realiza mezclando paulatinamente hasta que se alcanza el punto de equivalencia, momento en el que la reacción de neutralización ha sido completa. En ese momento el número de iones hidronio procedentes del ácido es igual al número de iones hidroxilo procedentes de la base.
· El punto final de la valoración se alcanza cuando se produce el cambio de color del indicador, es decir, cuando el operador que realiza la valoración detecta ese cambio de color
· El indicador adecuado para una determinada volumetría debe elegirse de manera que el punto final esté muy próximo al punto de equivalencia (menor error posible cometido en la valoración); o dicho de otra manera, que el valor del pKin esté muy próximo al valor del pH en el punto de equivalencia.
· Si el nº de moles de ácido = x· nº moles de base
(V·M)ácido = x · (V·M)base
dónde x viene determinada por la estequiometría de la reacción (x=1, 2, 3, ½ , ….)| Curva de valoración de AF-BF | Curva de valoración de BF-AF | Curva de valoración de AD-BF |
 |  |  |
Los indicadores que indican el punto de equivalencia no son igual de útiles para todas las reacciones.
- Reacciones de neutralización entre ácido fuerte (HCl) y base fuerte Na(OH). El pH en el punto de equivalencia es 7 ya que todos los iones hidronio han sido neutralizados por los iones hidroxilo, para dar H2O
El resto de los iones no reaccionan con el agua ya que:
- Cuando la neutralización se produce entre un ácido fuerte y una base débil. El catión de la base sufre una hidrólisis produciéndose iones hidronio, por lo que el pH es < 7.
- el Cl- procede de un ácido fuerte (es una base débil frente al agua): no se hidroliza.
- el Na+ procede de una base fuerte (es un ácido muy débil frente al agua): no se hidroliza.
- Cuando la neutralización se produce entre una base fuerte y un ácido débil. El anión del ácido sufre una hidrólisis produciéndose iones hidróxido, por lo que el pH es > 7.
- Cuando la neutralización se produce entre una base débil y un ácido débil. El anión del ácido sufre una hidrólisis al igual que el catión de la base, por lo que el pH es < 7 si es más débil la base y es >7 si es más débil el ácido.
La elección del indicador adecuado para determinar el punto de equivalencia dependerá del pH final, que tiene que estar dentro del intervalo en el que el indicador sufre el cambio de color.

PH
El pH es a la vez un término muy simple y muy complejo. El pH es un valor que te da el grado de acidez o alcanilidad de un producto, ya sea agua, jabón, la tierra,.. :
- La diferencia de pH entre elementos provoca reacciones químicas (reacciones ácido-base). Estas reacciones son una de las más importantes en la química, y responsables de las reacciones naturales del planeta.
- La primera medida de salud de nuestro océano/mar viene determinado por su pH.
- Es un valor que nos da la propia salud de nuestro cuerpo (a través de la orina, sangre y saliva).
En definitiva, no sólo gran parte de los experimentos de ciencias o acciones científicas, tienen relación con el pH. Muchísimas acciones de nuestro día a día, aunque no seamos conscientes de ello vienen determinados por el pH.
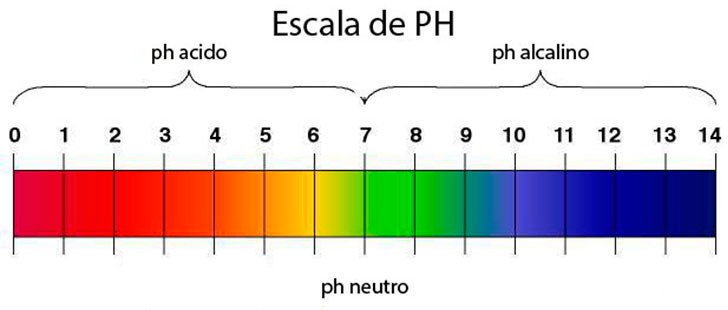
El pH es una medida de la acidez y de la alcalinidad de una sustancia. Tiene un rango que va desde 0 a 14. Una sustancia con pH entre 0 y 7 es una sustancia ácida y una sustancia entre 7 y 14 es una sustancia alcalina. El agua potable tiene un pH entre 6 y 9. Fuera de esos valores sería perjudicial para la salud, puesto que sería corrosiva. Cuando 2 sustancias tienen diferente pH (siendo una ácida y la otra alcalina) crean una reacción. Uno de los productos conocidos más ácidos sería el ácido clorhídrico (con pH menor de 1) y uno de los más alcalinos que conocemos sería la lejía (con pH cercano a 14).
A nivel de definición o concepto, de forma técnica, el pH El pH indica la concentración de iones del átomo de hidrógeno (H+) presentes en una disolución. La sigla de pH significa potencial de hidrógeno.
El pH es el logaritmo negativo de base 10 de la actividad de los iones hidrógeno:
El término pH se ha consolidado y es utilizado de forma universal ya que describe de forma sencilla lo que de otra forma habría que hacer con cifras muy complejas.
ESCALA DE PH
- Escala de pH. La escala del pH es una escala numérica que va de 0 a 14. El conocimiento de la escala es fundamental para poder trabajar con el pH.
MEDICIÓN DE PH
Existen diversas formas de medición del pH. Desde aparatos sencillos y caseros, tiras de medición, y también indicadores de medida. Según el grado de precisión que quieras obtener (y presupuesto y tiempo que vas a dedicar a la medición del pH), tienes diversas formas de medida del pH.
- Medidores de pH. Hoy en día encontrarás múltiples tablas y valores en Internet con muchísimos valores típicos del pH. No obstante el conocer cómo medir el pH, y poderlo aplicar es una técnica que nunca te va a faltar. Desde el pH en el agua de la piscina, hasta conocer el pH en el grifo de tu casa. Si quieres hacer jabones, cremas, cultivar plantas,… medir el pH va a ser fundamental. Aquí te presentamos algunos medidores de pH sencillos, como los ph-metros o los indicadores de pH, rojo fenol, fenolftaleína, azul de metileno
Los indicadores de pH son fundamentales para determinar la cantidad de pH que se encuentra en un medio específico. Cuando se habla del concepto de pH, este representa la concentración de iones de hidronio (H3O+) que se encuentra presente en una solución acuosa.
Asimismo, se mide en una escala logarítmica negativa entre 0 y 14, donde las soluciones con pH menores a 7 se consideran ácidas, las de pH mayores a 7 son básicas y las de pH igual a 7 se consideran soluciones neutras. Este parámetro se expresa de la siguiente manera con la ecuación de Henderson-Hasselbalch: pH = pKa + log10 ([A–]/[HA]).

En la expresión anterior, el pKa representa el logaritmo negativo de la constante de disociación de ácidos, y las concentraciones molares [A–] y [HA] son las del ácido débil y su base conjugada, respectivamente. Conocer el pH permite estudiar la calidad del agua y los alimentos, y poder mantener la repetibilidad de un producto químico elaborado.
Tipos
Existen tres tipos principales de indicadores de pH: indicadores líquidos ácido-base, que funcionan según un rango determinado de pH; los papeles y otros materiales indicadores que cambian de color según se le añada muestra líquida o gaseosa en su superficie; y los pH-metros digitales, que miden la diferencia eléctrica potencial entre dos electrodos.
Indicadores líquidos
Los indicadores líquidos son ácidos o bases orgánicas débiles que poseen colores variantes según su forma ácida o básica. Estos trabajan dentro de rangos limitados, variando de color una vez se alcanza este, y dejando de variar el color cuando se alcanza el nivel máximo del rango.
Para que funcionen deben ser usados únicamente en soluciones donde se pueda observar un cambio de color (preferiblemente incoloras).
Existe un gran número de indicadores líquidos de distintos colores y rangos de pH, incluyendo el rojo de cresol (rojo a amarillo en un rango de 0,2 a 1,8), el rojo de metilo (rojo a amarillo en un rango de 4,2 a 6,2), verde bromocresol (rosado a azul/verde de 4,2 a 5,2), y la fenolftaleína (incolora a rosada en un rango de 8,0 a 10,0).
Estos indicadores son populares para las titulaciones en la química analítica, aunque se debe tener cierto nivel de entrenamiento para llevar a cabo esta práctica de manera precisa.
Papeles indicadores
Existen varios tipos de papeles utilizados para la medición del pH, pero el más conocido es el llamado papel tornasol, el cual es elaborado con un polvo que proviene de líquenes.
El papel tornasol sirve para conocer si una solución líquida o gaseosa es ácida o básica (sin saber cuál será su pH exacto o un estimado del mismo), y viene en dos presentaciones: azul y rojo.
El papel tornasol azul cambia a rojo en condiciones ácidas, y el papel tornasol rojo cambia a azul en condiciones básicas o alcalinas, pudiendo reciclarse para realizar la prueba de manera inversa una vez el papel ya haya cambiado el color.
pH-metros
Los pH-metros nacen de la necesidad de los analistas de laboratorio de conseguir valores exactos de este parámetro, algo que no era posible con los indicadores de papel ni los indicadores líquidos.
Se basan en la medición del diferencial de potencial eléctrico entre el pH del electrodo y el electrodo de referencia.
El funcionamiento de estos medidores de pH se explica con más profundidad en la sección siguiente, pero en general estos indicadores se consideran los más precisos por excelencia, brindando un número preciso (a la exactitud de 0,01 unidades de pH) del parámetro y contando con una sensibilidad y rapidez superior a los otros dos métodos.
Además, también pueden medir otras características, como sólidos disueltos, conductividad eléctrica y temperatura de la solución.
La única desventaja de este tipo de medidores de pH es que son equipos delicados y, además de una calibración inicial que debe realizar un instrumentista o conocedor del equipo, también necesitarán ser limpiados regularmente para evitar que los electrodos sufran acumulación de material en estos.
¿Cómo funcionan?
Indicadores líquidos
Los indicadores líquidos cambian de color por acción de la protonación o desprotonación en su estructura (dependiendo de la naturaleza básica o ácida del indicador), la cual se basa en el equilibrio de la reacción, así: HIn + H2O ↔ H3O+ + In–
Es decir, que una vez agregado el indicador a la solución, si el equilibrio de este medio comienza a tender al sentido opuesto por aumento o disminución del ión hidronio (de nuevo, dependiendo de la naturaleza del indicador), este cambiará de color hasta finalmente quedarse de un color nuevo invariable.
Papeles indicadores
Los papeles indicadores, en específico el papel tornasol, deben entrar en contacto con la solución a analizar de manera discreta para poder medir con precisión.
Es decir, en una solución líquida este no debe ser introducido por completo en ella, sino que deberá ser goteado con esta o tocar brevemente una muestra de la sustancia.
En el caso de una solución gaseosa, el gas debe pasar sobre la superficie del papel para permitir que haga contacto y este cambie de color.
pH-metros
Como se dijo anteriormente, los pH-metros funcionan por la diferencia eléctrica potencial entre un electrodo de pH y uno de referencia.
El pH-metro mide el voltaje que existe entre dos electrodos en una solución y muestra el resultado convertido en un valor de pH correspondiente.
El equipo en sí consiste en un par de electrodos —uno de los cuales es metálico e insensible al pH de la solución— y un amplificador electrónico sencillo. Para su calibración, el equipo es calibrado con soluciones de pH conocido.
La titulación es un procedimiento cuantitativo analítico de la química. Con la titulacion puede determinar la concentración desconocida en un líquido añadiéndole reactivos de un contenido conocido. La titulación es un procedimiento relativamente sencillo que no requiere un despliegue de aparatos técnicos para determinar la concentración de sustancias conocidas disueltas. Los instrumentos esenciales para la titulacion son una bureta y un vaso de precipitados.
La bureta contiene una solución volumétrica de la cual se conoce la concentración de la sustancia. En el vaso de precipitados se encuentra la solución con la concentración desconocida y un indicador para la detección del parámetro. Después de mezclar la solución volumétrica y la solución con la muestra en el vaso de precipitados es posible, en base al conocimiento del desarrollo químico de reacción y el consumo de la solución volumétrica, calcular la concentración de la solución con la muestra. Los diferentes procedimientos de titulación se pueden separar según los tipos de reacción químicos.
Por ejemplo, existe la titulación ácido-base, la titulación redox o la titulación por precipitación. La titulación es aplicada en muchos ámbitos: En el análisis medioambiental, en el control de procesos, en el análisis farmacológico y forense, en el análisis de alimentos o también en la investigación. Si tiene más pregunta sobre la titulación, use por favor nuestro formulario de contacto.


Titulación ácido-base: El fundamento de la titulación ácido-base es la reacción de neutralización entre ácidos y base. Como solución volumétrica se selecciona un ácido o base como complemento a la solución de prueba. Mediante la titulación se consigue una neutralización entre iones H3O+- y OH-. Si se alcanza el valor pH 7 la solución es neutra; añadiendo más solución volumétrica la solución de prueba se volverá más ácido o básico. Si se registra en una curva el desarrollo del valor pH a través de todo el desarrollo de la reacción, es posible determinar la cantidad a raíz del punto de equivalencia (valor pH 7).
Titulación redox: En la titulación redox se deja reaccionar la solución de prueba con una solución volumétrica oxidada o reducida. Se añade la solución volumétrica hasta que todas las sustancias que puedan reaccionar en la solución de prueba hayan sido oxidadas o reducidas. Solamente se consiguen resultados si el punto de saturación de la solución de prueba no se sobrepasa añadiendo más solución volumétrica. Por tanto, es imprescindible conocer el punto de saturación para determinar con precisión el valor de medición. Esto se consigue de forma muy precisa mediante indicadores químicos o potenciométricos.
Titulación por precipitación: La titulación por precipitación combina muy bien sustancias muy solubles con sustancias que no se diluyen tan bien. Se consigue obtener el resultado una vez que la reacción química se ha completado y sea claramente visible la caída de la sustancia que se diluye con dificultad.
- El pH es una unidad de medida que sirve para establecer el nivel de acidez o alcalinidad de una sustancia.
- La valoración o titulación es un método de análisis químico cuantitativo en el laboratorio que se utiliza para determinar la concentracióndesconocida de un reactivo a partir de un reactivo con concentración conocida. Debido a que las medidas de volumen desempeñan un papel fundamental en las titulaciones, se le conoce también como análisis volumétrico.
- La reacción entre un ácido y una base se denomina neutralización.
Webgrafia



![{\mbox{pH}}=-\log _{{10}}\left[{\mbox{a}}_{{H^{+}}}\right]](https://wikimedia.org/api/rest_v1/media/math/render/svg/04c5c5a7ad592410ab02d87dff3b00c1c636982e)






LOS INFORMES ERAN POR SEPARADO Y FALTO EJERCICIOS DE NEUTRALIZACION 4,0
ResponderBorrar