HIDRÓGENO Y OXIGENO
INTRODUCCIÓN
Con este trabajo se busca informar a las estudiantes sobre el oxigeno y el hidrógeno, de cual es su estado natural, las propiedades físicas y químicas, como se obtienen, como se reconocen y finalmente la aplicación de estos elementos
OBJETIVOS GENERALES
- Explicar toda la información sobre los elementos oxigeno e hidrógeno
- Informar a las estudiantes de cuales son las funciones del oxigeno y del hidrógeno
- Identificar las falencias en las estudiantes sobre este tema
- Crear en las estudiantes conocimientos como cual es el estado natural, sus propiedades físicas y químicas, como se obtienen, como se reconocen y cual es la aplicación del hidrógeno y el oxigeno
MARCO TEÓRICO
OXIGENO
La llama o flama al proceso en el cual la combustión es producida en un elemento inflamable que se encuentra en una atmósfera con mucho oxígeno y se enciende una emisión de luz intensa. Las muchas reacciones de combustión son exotérmicas despiden una gran energía que se expresa en forma de calor.

El oxígeno es un elemento clave de la química orgánica, al formar parte del agua (H2O), de los óxidos, de los seres vivos y de casi todos los ácidos y sustancias orgánicas. Se trata de un gas incoloro, inodoro e insípido, que es muy reactivo y que resulta esencial para la respiración.
CARACTERÍSTICAS DEL OXIGENO
El oxígeno es un gas incoloro (en estado líquido y sólido toma un color azul pálido), inodoro e insípido que integra el grupo de los anfígenos de la tabla periódica y que, siendo un no metal, se caracteriza especialmente por su alta reactividad.
Precisamente por ésto último es que el oxígeno forma parte de cientos y cientos de miles de compuestos orgánicos y se combina con la gran mayoría del resto de los elementos.
Abunda en el Sol, siendo el tercer elemento más abundante en el astro y primordial en el desarrollo de los ciclos de carbono-nitrógeno, el mismísimo proceso que le da la gran energía al Sol y al resto de las estrellas. Bajo determinadas condiciones, es el oxígeno lo que le da esas tonalidades rojas, brillantes, verdes y amarillentas a las auroras boreales. Esto lo vimos cuando te enseñé algunas de las mejores fotografías de auroras boreales y hablamos acerca de su formación, ¿recuerdas?
Sin irnos del tema, el oxígeno constituye el 21% de la atmósfera de la Tierra en volumen y puede obtenerse mediante licuefacción y destilación fraccionada que, en nuestro idioma, básicamente es un proceso a través del cual se convierten gases en líquidos, manipulando la temperatura y la presión.
La Tierra no es el único lugar en el que hay oxígeno y además de abundar en el Sol, por ejemplo, la atmósfera de Marte tiene cerca de un 0,15% de oxígeno. Mucho más cerca, dos tercios de la masa de la masa del cuerpo humano se compone de oxígeno y una nueve décimas de la masa de agua. La corteza terrestre también se compone de este elemento, la cual compone prácticamente la mitad de su masa.
El oxígeno posee nueve isótopos, el natural es una mezcla de tres de ellos. El del oxígeno-18, que se produce de forma natural, es estable y se comercializa libremente en el mercado, en forma de agua.
El tan importante trioxígeno, más conocido como ozono, es una molécula compuesta por tres átomos de oxígeno, éste forma una capa protectora en la atmósfera y que es fundamental para prevenir los daños que la luz ultravioleta del Sol nos puede causar.
PROPIEDADES FÍSICAS DEL OXIGENO
En condiciones normales de presión y temperatura (STP), el oxigeno se encuentra en estado gaseoso formando moléculas diatónicas (O2). Al igual que el hidrógeno, no posee propiedades organolépticas, es decir es incoloro, inodoro e insípido.
El oxigeno se condensa a -183oC en un líquido azul pálido. Se solidifica a -219oC en un sólido blando azulado. Para ambos estados de agregación es muy paramagnético, es decir, sus regiones más probables de encontrar electrones u orbitales tienden a alinearse paralelamente cuando están en presencia de un campo magnético.
 Si se suministra energía al oxígeno diatómico se obtiene la otra forma alotrópica del oxigeno conocida como ozono, de acuerdo con la reacción siguiente:
Si se suministra energía al oxígeno diatómico se obtiene la otra forma alotrópica del oxigeno conocida como ozono, de acuerdo con la reacción siguiente:
3Oo (g) → 2O3 (g)
La estructura de Lewis consideraba para el oxigeno presenta electrones sin pareja que violentan la regla del octeto, pero justifican el carácter paramagnético del oxígeno molecular, de acuerdo al cual el oxígeno es atraído por un campo magnético, tanto en su estado gaseoso como en estado líquido.
El ozono no es magnético, por tanto se le considera una estructura en la cual todos los electrones están apareados.
El ozono tiene un olor fuerte y penetrante. Éste es más soluble en agua que el oxigeno debido a que las moléculas del O3 son polares, sin embargo las del O2 no lo son.
Si llevamos el ozono a una temperatura de -111.5 oC se convierte en un líquido azul intenso de carácter fuertemente explosivo. El ozono es un agente oxidante fuerte. Sus aplicaciones se basan, precisamente, en su fuerte carácter oxidante.
El ozono se usa como germicida, como decolorante de ceras, féculas, grasas y barnices.
El oxigeno tiene tres isótopos estables y diez radiactivos. Los radioisótopos tienen todos una vida media de menos de tres minutos.
En condiciones normales de presión y temperatura (STP), el oxigeno se encuentra en estado gaseoso formando moléculas diatónicas (O2). Al igual que el hidrógeno, no posee propiedades organolépticas, es decir es incoloro, inodoro e insípido.
El oxigeno se condensa a -183oC en un líquido azul pálido. Se solidifica a -219oC en un sólido blando azulado. Para ambos estados de agregación es muy paramagnético, es decir, sus regiones más probables de encontrar electrones u orbitales tienden a alinearse paralelamente cuando están en presencia de un campo magnético.

3Oo (g) → 2O3 (g)
La estructura de Lewis consideraba para el oxigeno presenta electrones sin pareja que violentan la regla del octeto, pero justifican el carácter paramagnético del oxígeno molecular, de acuerdo al cual el oxígeno es atraído por un campo magnético, tanto en su estado gaseoso como en estado líquido.
El ozono no es magnético, por tanto se le considera una estructura en la cual todos los electrones están apareados.
El ozono tiene un olor fuerte y penetrante. Éste es más soluble en agua que el oxigeno debido a que las moléculas del O3 son polares, sin embargo las del O2 no lo son.
Si llevamos el ozono a una temperatura de -111.5 oC se convierte en un líquido azul intenso de carácter fuertemente explosivo. El ozono es un agente oxidante fuerte. Sus aplicaciones se basan, precisamente, en su fuerte carácter oxidante.
El ozono se usa como germicida, como decolorante de ceras, féculas, grasas y barnices.
El oxigeno tiene tres isótopos estables y diez radiactivos. Los radioisótopos tienen todos una vida media de menos de tres minutos.
PROPIEDADES QUÍMICAS
- Número atómico: 8
- Peso atómico: 15,9994
- Símbolo atómico: O
- Punto de fusión: -218,79° C
- Punto de ebullición: -182,95°C
- Ubicación: perteneciente al grupo VI de la tabla periódica
- Configuración electrónica: 1s2 2s2 2p4
- Densidad: 1,42 g/cm3
- Número de protones/electrones: 8
- Número de neutrones: 8
- Clasificación: no metal
- Color: no tiene (incoloro)
- Año de descubrimiento: 1774
- Descubridor: Joseph Priestly
- Nombre de origen: de las palabras griegas oxus (ácido) y gennan (generar)
- Usos: sustenta la vida
- Obtenido de: aire líquido
LA LLAMA
La llama o flama al proceso en el cual la combustión es producida en un elemento inflamable que se encuentra en una atmósfera con mucho oxígeno y se enciende una emisión de luz intensa. Las muchas reacciones de combustión son exotérmicas despiden una gran energía que se expresa en forma de calor.
 La llama se produce a causa de la emisión de energía de los átomos que tienen partículas específicas están ubicadas en los gases de combustión, estos son llevados a este suceso debido al gran calor que se produce en estas reacciones. El color de la llama dependerá del medio en que se produzca y se utilice el quemador, lo que se logra con el combustible y el comburente.
La llama se produce a causa de la emisión de energía de los átomos que tienen partículas específicas están ubicadas en los gases de combustión, estos son llevados a este suceso debido al gran calor que se produce en estas reacciones. El color de la llama dependerá del medio en que se produzca y se utilice el quemador, lo que se logra con el combustible y el comburente.
Dependiendo de la combustión la llama puede ser más intensa, oscura u opaca, donde la calentura de la misma dependerá de la composición de los elementos antes mencionados (comburente y la combustión).
PARTES DE LA LLAMA
- Llamas de Premezcla
Sucede cuando el comburente y el combustible se mezclan antes de que se realice la combustión. La combustión de estaciones es más completa y llegan a tener temperaturas más grandes, caracterizándose por su tono azul. Dependiendo de las fórmulas se pueden mencionar tres zonas como son precalentamiento, reacción y zona de post reacción.
- Zona de precalentamiento
 Surge cuando se tiene la mezcla del combustible y el comburente cuando todavía no existe la temperatura requerida para entrar en acción, esta aumenta según la proximidad de la zona siguiente.
Surge cuando se tiene la mezcla del combustible y el comburente cuando todavía no existe la temperatura requerida para entrar en acción, esta aumenta según la proximidad de la zona siguiente. - Zona de reacción
Se da porque cuando se llega a la temperatura de ignición, en la que se produce una reacción de la mezcla, dejando escapar el calor y estableciendo productos que funcionan como reactivos ante los procesos químicos utilizados para formar la llama.
- Zona de post reacción
En esta zona los gases resultados de la reacción de la zona anterior se enfrían y no emiten luz. Se puede decir que en esta zona los componentes descansan hasta que pasan a otro nivel en el que si se podrá emitir la luz de la llama.
- Llamas de difusión
Son llamas producidas naturalmente, reacción que se da al encontrarse el aire y el combustible sin haberse mezclado en el mismo lugar. La difusión permite que el gas inflamable se produzca y se combine de forma natural con el oxígeno que posee el aire. Esta parte de la llama sucede en la zona de reacción y se caracteriza por tener una corta prolongación. Esta parte tiene tres modelos de zonas:
- Zona interna
En esta zona la cera de la vela se vaporiza rodeando de esta manera a la mecha y creando una zona donde solamente hay gases combustibles que no combustionan. Esta parte de la zona también se llama zona oscura o zona fría debido a que no hay emisión de luz.
- Zona intermedia
Al borde de la zona interna el combustible se mezcla con el oxígeno circundante efectuando la combustión. Aquí la temperatura es bastante elevada, lo que permite que se produzca emisión de luz.
- Zona externa
Aquí abunda el oxígeno circundante y los radicales libres que han sido creados en las zonas de más alta temperatura, es decir la zona intermedia, donde se combina con el oxígeno, haciendo real la oxidación de la llama y logrando que salga en forma de hollín.
- Modelo de cuatro zonas
Este modelo explica que existen zonas en la que la combustión presenta similitudes con las llamas de premezcla, específicamente en los lugares donde obtienen mayor cantidad de oxígeno
DESCUBRIMIENTO DEL OXIGENO
El descubrimiento del oxígeno se produjo entre 1772 y 1773 por parte del químico sueco, de origen alemán, Karl Wilhelm Scheele (1742-1786). Por esa misma época, el británico Joseph Priestley (1733-1804) también descubrió el oxígeno de manera independiente, mientras que el francés Antoine Lavoisier (1743-1794) fue el primero en publicar un estudio sobre este elemento químico, en 1777.

OBTENCIÓN DEL OXIGENO
El aire se compone aproximadamente, de un 21 % de oxígeno, un 78 % de nitrógeno y pequeñas cantidades de gases raros, tales cómo el helio, el argón y el neón. Para obtener el oxígeno, tal como se utiliza en soldadura, es necesario separarlo del resto de gases que componen el aire.
Desde el punto de vista Industrial, pueden seguirse dos procedimientos para la obtención del oxígeno: la electrólisis del agua y la destilación fraccionada del aire.
Para la obtención por electrólisis, se prepara una solución de sosa cáustica en agua, y se introducen en la misma dos electrodos conectados a un generador de corriente continua. Al circular la corriente eléctrica a través de la solución, se produce la descomposición del agua en sus dos elementos integrantes, recogiéndose el oxígeno, en forma gaseosa, en uno de los electrodos, y el hidrógeno, en el otro. Este procedimiento resulta muy costoso y apenas se emplea, por lo que el oxígeno para aplicaciones Industriales suele obtenerse por destilación fraccionada del aire.
El aire atmosférico se recoge en grandes depósitos que se conocen como torres de lavado. A través de estas torres se hace circular una solución de sosa cáustica, que somete al aire a un proceso de lavado, eliminando el anhídrido carbónico.
Desde el punto de vista Industrial, pueden seguirse dos procedimientos para la obtención del oxígeno: la electrólisis del agua y la destilación fraccionada del aire.
Para la obtención por electrólisis, se prepara una solución de sosa cáustica en agua, y se introducen en la misma dos electrodos conectados a un generador de corriente continua. Al circular la corriente eléctrica a través de la solución, se produce la descomposición del agua en sus dos elementos integrantes, recogiéndose el oxígeno, en forma gaseosa, en uno de los electrodos, y el hidrógeno, en el otro. Este procedimiento resulta muy costoso y apenas se emplea, por lo que el oxígeno para aplicaciones Industriales suele obtenerse por destilación fraccionada del aire.
El aire atmosférico se recoge en grandes depósitos que se conocen como torres de lavado. A través de estas torres se hace circular una solución de sosa cáustica, que somete al aire a un proceso de lavado, eliminando el anhídrido carbónico.
A la salida de la torre de lavado el aire se comprime y se hace a través de unos depuradoras en los que se eliminan las partículas de aceite y el vapor de agua.
De aquí el agua pasa a los cilindros de secado. Estos cilindros contienen potasa cáustica, que seca el aire y elimina cualquier residuo de anhídrido carbónico y vapor de agua. En el extremo superior de estos cilindros existen nuevos filtros de un algodón especial, que evitan que cualquier sustancia extraña pueda pasar a las líneas de alta presión.
Partiendo del aire en estado líquido resulta sencillo separar el oxígeno y el nitrógeno, debido a la diferencia de temperaturas de ebullición de ambos gases (-195,5º C, para el nitrógeno y ---182º C para el oxígeno). El nitrógeno, que tiene una temperatura de ebullición más baja, se evapora primero, dejando un residuo de oxígeno líquido en el fondo del condensador.
A continuación, el oxígeno líquido pasa a través de un serpentín en el que se calienta hasta pasar al estado gaseoso. El gas producido se controla con un caudalímetro y se almacena en grandes tanques. De aquí se recoge para cargar las botellas tal como se utilizan en la Industria.

APLICACIÓN Y USO DEL OXIGENO
Respiración: Las plantas y animales dependen del oxígeno para respirar. Los humanos y animales inhalan oxígeno a los pulmones, o en el caso de los anfibios, a través de las branquias o la piel. El oxígeno le da energía a las células de la sangre antes de ser liberado como dióxido de carbono.
 En medicina: Suministrándolo como suplemento a pacientes con dificultades respiratorias,El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, facilitando el trabajo de bombeo del corazón. La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno y se emplean botellas de oxígeno en diversas prácticas deportivas como el submarinismo o laborales, en el caso de acceder a lugares cerrados, o escasamente ventilados, con atmósferas contaminadas.
En medicina: Suministrándolo como suplemento a pacientes con dificultades respiratorias,El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, facilitando el trabajo de bombeo del corazón. La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno y se emplean botellas de oxígeno en diversas prácticas deportivas como el submarinismo o laborales, en el caso de acceder a lugares cerrados, o escasamente ventilados, con atmósferas contaminadas.

En cohetes: En su forma líquida, el oxígeno es usado como un agente desoxidante en misiles y cohetes. El tanque exterior de gasolina que se usa para elevar a una nave espacial fuera del atmósfera contiene cerca de 145.000 galones de oxígeno líquido (548 884 litros) y cerca de 390.000 galones de hidrógeno líquido (1.476.310 litros). Los dos elementos reacciones en los motores principales para generar un impulso máximo de 512.000 libras (232.239 kilos).
 Metalurgia: La producción del acero depende del oxígeno. Se usa en un horno alto para convertir el carbono en dióxido de carbono, lo que reduce el óxido de hierro en hierro puro. El oxígeno también es usado en los sopletes de corte y soldadura. El oxígeno reacciona con el hidrógeno o el acetileno en los sopletes, los que se pueden calentar a más de 5.000 grados F (2760 grados centígrados). Estos sopletes pueden cortar o soldar la mayoría de metales.
Metalurgia: La producción del acero depende del oxígeno. Se usa en un horno alto para convertir el carbono en dióxido de carbono, lo que reduce el óxido de hierro en hierro puro. El oxígeno también es usado en los sopletes de corte y soldadura. El oxígeno reacciona con el hidrógeno o el acetileno en los sopletes, los que se pueden calentar a más de 5.000 grados F (2760 grados centígrados). Estos sopletes pueden cortar o soldar la mayoría de metales.
Ciencia: Los paleoclimatólogos miden la relación entre el oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos marinos para determinar cómo era el clima hace millones de años. Las moléculas de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12 % más pesado); esta disparidad se incrementa a bajas temperaturas. En periodos con una temperatura global más baja, la nieve y la lluvia procedentes de esa agua evaporada tienden a ser más ricas en oxígeno-16, mientras que el agua marina que queda tiende a serlo en oxígeno-18. Los organismos marinos, por tanto, incorporan más oxígeno-18 en sus esqueletos y exoesqueletos de lo que harían en un medio más cálido. Los paleoclimatólogos también miden directamente esta relación en las moléculas de agua de muestras de núcleo de hielo que se han coservado durante varios cientos de miles de años.
Los geólogos planetarios han medido las diferencias en la abundancia de isótopos de oxígeno en muestras de la Tierra, la Luna,Marte y meteoritos, pero no han estado lejos de poder obtener valores de referencia para las relaciones entre isótopos del Sol, que se creen iguales a aquellas de la nebulosa protosolar. Sin embargo, el análisis de una oblea de silicio expuesta al viento solar en el espacio y devuelta a la Tierra por la sonda Génesis desveló que el Sol tiene una proporción de oxígeno-16 mayor que nuestro planeta. La medición implica que un proceso desconocido agotó el oxígeno-16 del disco protoplanetario del Sol antes de la fusión de los granos de polvo que formaron la Tierra
El hidrógeno, el primero de los elementos de la tabla periódica, es también el elemento químico más ligero que existe y además, no solo es el más abundante de nuestro planeta, sino el del universo entero, ocupando casi el 74% de toda la materia visible del universo.
 En medicina: Suministrándolo como suplemento a pacientes con dificultades respiratorias,El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, facilitando el trabajo de bombeo del corazón. La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno y se emplean botellas de oxígeno en diversas prácticas deportivas como el submarinismo o laborales, en el caso de acceder a lugares cerrados, o escasamente ventilados, con atmósferas contaminadas.
En medicina: Suministrándolo como suplemento a pacientes con dificultades respiratorias,El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, facilitando el trabajo de bombeo del corazón. La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno y se emplean botellas de oxígeno en diversas prácticas deportivas como el submarinismo o laborales, en el caso de acceder a lugares cerrados, o escasamente ventilados, con atmósferas contaminadas.
En cohetes: En su forma líquida, el oxígeno es usado como un agente desoxidante en misiles y cohetes. El tanque exterior de gasolina que se usa para elevar a una nave espacial fuera del atmósfera contiene cerca de 145.000 galones de oxígeno líquido (548 884 litros) y cerca de 390.000 galones de hidrógeno líquido (1.476.310 litros). Los dos elementos reacciones en los motores principales para generar un impulso máximo de 512.000 libras (232.239 kilos).
 Metalurgia: La producción del acero depende del oxígeno. Se usa en un horno alto para convertir el carbono en dióxido de carbono, lo que reduce el óxido de hierro en hierro puro. El oxígeno también es usado en los sopletes de corte y soldadura. El oxígeno reacciona con el hidrógeno o el acetileno en los sopletes, los que se pueden calentar a más de 5.000 grados F (2760 grados centígrados). Estos sopletes pueden cortar o soldar la mayoría de metales.
Metalurgia: La producción del acero depende del oxígeno. Se usa en un horno alto para convertir el carbono en dióxido de carbono, lo que reduce el óxido de hierro en hierro puro. El oxígeno también es usado en los sopletes de corte y soldadura. El oxígeno reacciona con el hidrógeno o el acetileno en los sopletes, los que se pueden calentar a más de 5.000 grados F (2760 grados centígrados). Estos sopletes pueden cortar o soldar la mayoría de metales.Ciencia: Los paleoclimatólogos miden la relación entre el oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos marinos para determinar cómo era el clima hace millones de años. Las moléculas de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12 % más pesado); esta disparidad se incrementa a bajas temperaturas. En periodos con una temperatura global más baja, la nieve y la lluvia procedentes de esa agua evaporada tienden a ser más ricas en oxígeno-16, mientras que el agua marina que queda tiende a serlo en oxígeno-18. Los organismos marinos, por tanto, incorporan más oxígeno-18 en sus esqueletos y exoesqueletos de lo que harían en un medio más cálido. Los paleoclimatólogos también miden directamente esta relación en las moléculas de agua de muestras de núcleo de hielo que se han coservado durante varios cientos de miles de años.
Los geólogos planetarios han medido las diferencias en la abundancia de isótopos de oxígeno en muestras de la Tierra, la Luna,Marte y meteoritos, pero no han estado lejos de poder obtener valores de referencia para las relaciones entre isótopos del Sol, que se creen iguales a aquellas de la nebulosa protosolar. Sin embargo, el análisis de una oblea de silicio expuesta al viento solar en el espacio y devuelta a la Tierra por la sonda Génesis desveló que el Sol tiene una proporción de oxígeno-16 mayor que nuestro planeta. La medición implica que un proceso desconocido agotó el oxígeno-16 del disco protoplanetario del Sol antes de la fusión de los granos de polvo que formaron la Tierra
HIDRÓGENO

CARACTERÍSTICAS DEL HIDRÓGENO
El hidrógeno es la forma más simple de un átomo y se cree que el más abundante, ya desde los primeros momentos después del Big Bang. Descubierto en el año 1766, por el físico-químico británico Henry Cavendish, fue nombrado a partir del griego Hydro (agua) y Gen (generador), pues como todos sabemos, al combinarse con oxígeno forman agua. Se trata de un elemento químico incoloro, inodoro, de tipo gaseoso y no metálico, además, su masa atómica es tan ligera (1,00797) que no existe ningún otro elemento químico más liviano que el hidrógeno.
Además de representar las tres cuartas partes de la materia del universo, se estima que el hidrógeno reŕesenta más del 90% de los átomos de nuestro planeta. El hidrógeno juega un papel fundamental en la alimentación del universo, tanto a través de la reacción protón-protón como en el ciclo carbono-nitrógeno. En los procesos de fusión de hidrógeno estelar, se liberan cantidades masivas de energía a través de la combinación del hidrógeno para formar helio.
Júpiter, al igual que muchos otros planetas gaseosos de gran tamaño, están compuestos mayoritaria y especialmente por hidrógeno. A una profundidad determinada, en el interior del planeta, la presión es tan grande que el hidrógeno molecular sólido se convierte en hidrógeno metálico sólido. Aunque el hidrógeno en estado puro es un gas sumamente liviano, hay un poco de éste en la atmósfera, éste es tan ligero que si no se combina, alcanza en sus colisiones las velocidades suficientes como para ser expulsadas de la atmósfera fácilmente.

- Símbolo: H
- Número atómico: 1
- Grupo de la tabla periódica: 1A
- Configuración electrónica: 1s1
- Masa atómica: 1,008
- Densidad: 0,0899 g/cm3
- Punto de fusión: – 259,14 °C
- Punto de ebullición: -252,87 °C
- Número de protones/electrones: 1
- Número de neutrones: 0
- Clasificación: no metálico
- Estructura cristalina: hexagonal
- Color: incoloro
- Año de descubrimiento: 1766
- Descubridor: Henry Cavendish
- Nombre de origen: proveniente de las palabras griegas hudor (agua) ygennan (generar).

PROPIEDADES FÍSICAS DEL HIDRÓGENO
El hidrógeno es fácilmente absorbido por ciertos metales finamente divididos, siendo los principales paladio, platino y oro. Por ejemplo, uno volumen de paladio finamente dividido puede adsorber aproximadamente 850 volumen es de Hidrógeno a temperatura ambiente. El hidrógeno absorbido es muy activo químicamente.
PROPIEDADES QUÍMICAS
La ecuación anterior nos indica la gran cantidad de energía desprendida por la reacción.
Una propiedad muy importante del hidrógeno es su poder reductor. En efecto, a altas temperatura el hidrógeno reacciona con algunos óxidos reduciéndolos.
Este poder reductor, que se base en la tendencia del hidrógeno a oxidarse al estado de oxidación +1, tiene además aplicación en muchos procesos químicos.

OBTENCIÓN DEL HIDRÓGENO
El hidrógeno se obtiene mediante diversos procesos:
- electrólisis
- reformado
- gasificación
- ciclos termoquímicos
- producción biológica

La electrólisis es un proceso que consiste en la descomposición del agua a través de la utilización de la electricidad. Este proceso industrial tiene sus ventajas, pues es fácilmente adaptable ya sea para grandes o pequeñas cantidades de gas, consiguiéndose un hidrógeno de gran pureza. La electrolisis también posee la ventaja de poder combinarse y relacionarse de manera óptima con las energías renovables con el fin de producir H2.
Reformado:
El reformado, consiste en la reacción de los hidrocarburos con la presencia de calor y vapor de agua. Dicho método permite producir grandes cantidades de hidrógeno con un bajo coste, partiendo del gas natural. Como desventaja de éste método, podemos decir, que a pequeña escala no es muy rentable ni comercial, y el hidrógeno producido suele contener impurezas, siendo incluso en ciertas ocasiones necesaria la limpieza posterior, o la realización de reacciones secundarias, con el fin de intentar purificar el producto de hidrógeno. Se suele relacionar fácilmente con la fijación del CO2, o almacenamientos de carbono, lo que hace que las emisiones del CO, incluido su proceso de fijación, supongan un problema para este método, pues genera una serie de costes adicionales.
Gasificación:
El hidrógeno a través del proceso de gasificación, se obtiene a partir de hidrocarburos pesados y la biomasa, obteniéndose además del hidrógeno, gases para reformado, a partir de las reacciones del vapor de agua y el oxígeno.
Este método es muy adecuado cuando se trata de hidrocarburos a gran escala, pudiendo ser usados el carbón, los combustibles sólidos, y líquidos.
El hidrógeno obtenido por gasificación, presenta semejanzas con otros derivados sintéticos de la biomasa, produciendo competencia entre ellos. La gasificación de la biomasa es aún hoy en día objeto de estudio, y posee implicaciones y limitaciones pues necesita grandes extensiones de terreno.
Ciclos termoquímicos:
Este proceso utiliza el calor de bajo coste producido de la alta temperatura que procede de la energía nuclear o también de la energía solar concentrada.
Es un proceso bastante utilizable y atractivo cuando se habla de gran escala, al tener bajo coste económico, y no emitiendo gases de carácter invernadero, pudiendo ser usado en la industria pesada o incluso en el transporte. Existen distintos proyectos de colaboraciones internacionales para investigar y desarrollar este método. Hoy en día, aún falta mayor investigación sin fines comerciales.
Producción biológica:
Las bacterias, y las algas, producen hidrógeno de manera natural y directa, cuando se encuentran en determinadas condiciones. Este proceso, durante los últimos años, ha sido muy estudiado, debido a su gran potencial, pero hay que decir que es un proceso bastante lento de obtención del hidrógeno, y además se necesitan grandes superficies, sin mencionar que la gran mayoría de los organismos apropiados para éste método, no se han encontrado todavía, aunque es un proceso en pleno estudio y desarrollo.
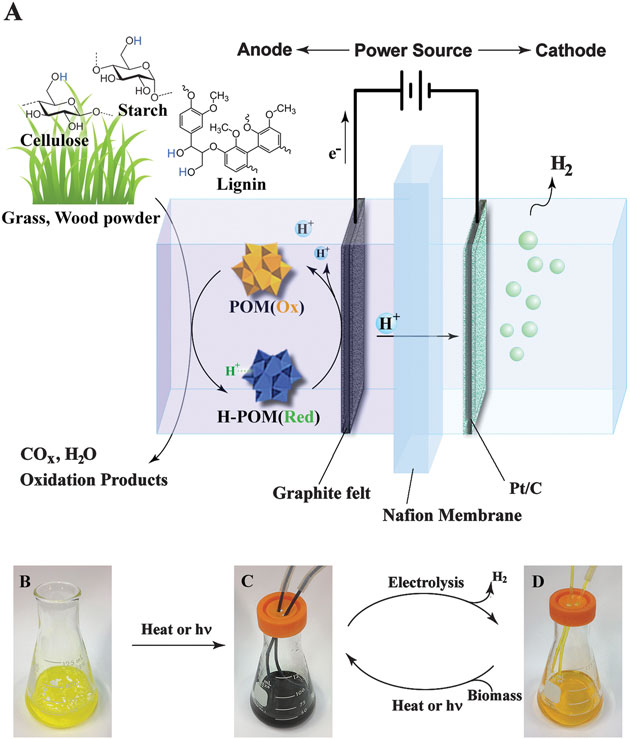
APLICACIONES Y USOS DEL HIDRÓGENO
El hidrógeno es uno de los elementos con mayor importancia en nuestro día a día. Existen dos átomos de hidrógeno en cada molécula de agua y una buena parte de los átomos que constituyen las moléculas que soportan la vida son de hidrógeno.
El hidrógeno es el elemento más liviano, siendo el núcleo de su isótopo más abundante constituído únicamente por un protón. El hidrógeno es el elemento con mayor abundancia en el Universo conocido y uno de los más abundantes en la Tierra.
Pero además de su importancia en el mundo natural, es también de enorme importancia industrial y su producción es frecuentemente un factor limitante en la industria.
Elevadas cantidades de hidrógeno son necesarias en industrias químicas y petrolíferas, nominadamente en el proceso de “Haber” para la producción de amoníaco, el quinto compuesto con mayor producción industrial.
Además de la producción de amoníaco, el hidrógeno es también utilizado en la hidrogenación de grasas y aceites, hidrosulfuración, hidrockaking, hidroalquilaciones, así como en la producción de metanol entre otras.
El hidrógeno está actualmente siendo testeado como fuente de energía “limpia” para la utilización en transportes. La reacción del hidrógeno con el oxígeno, para producir agua, realizada en células de combustibles es una de las formas más promisorias para generar energía para automóviles, evitando la liberación de gases de efecto invernadero, al contrario de lo que sucede con los motores actuales que utilizan la combustión de hidrocarburos de origen fósil.
Otra enorme promesa del hidrógeno a nivel de la energía es la fusión nuclear. Este proceso, que alimenta la mayor parte de las estrellas que brillan en el firmamento, produce helio a partir de núcleos de hidrógeno, liberando enormes cantidades de energía.
Esta reacción, que ya fue utilizada en su forma “descontrolada” en las bombas de hidrógeno, se fuese llevada a cabo de una forma controlada, podrá permitir tener una fuente de energía casi inagotable.
Otras aplicaciones relevantes del hidrógeno son:
- Producción de ácido clorhídrico (HCl)
- Combustible para cohetes
- Enfriamiento de rotores en generadores eléctricos en puestos de energía, visto que el hidrogeno posee una elevada conductividad térmica;
- En estado líquido es utilizado en investigaciones criogénicas, incluyendo estudios de superconductividad.
El deuterio, un isótopo del hidrógeno en que el núcleo es constituído por un protón y un neutrón, es utilizado en la forma de la llamada “agua pesada” en fisión nuclear como moderador de neutrones.
Compuestos de deuterio poseen aplicaciones en química y en biología en estudios de reacciones utilizando el efecto isotópico.

CONCLUSIONES
- El hidrógeno y el oxigeno están estrechamente relacionados
- Estos dos elementos son esenciales para la vida tal como la conocemos pues proveen varias cosas fundamentales en los seres vivos
- Sus aplicaciones son muy variadas e importantes
- Los dos se obtienen de una manera similar, un ejemplo de ello es la electrolisis, donde se obtienen los dos
- Los dos son fácilmente combinables con otros elementos
- Estos dos elementos son gases y no son tangibles
WEBGRAFIA
https://www.monografias.com/trabajos94/oxigeno-y-su-descubrimiento/oxigeno-y-su-descubrimiento.shtml






FALTO MARCO TEORICO EN GASES 4.3
ResponderBorraryoutube - Vimeo
ResponderBorraryoutube - Vimeo.com Videos - VideoDigger iphone - iOS, Android, iOS, iphone - Android, iPhone, Tablet, Android iphone - download youtube videos iOS, Android, iOS, iPhone, Tablet